Az oxidatív addíció során egy szubsztrát molekula (jelöljük XY-nal) reagál a fémkomplexszel, és a reakció során az X-Y kötés felhasad, azonban a fémen két új kötés, egy M-X és egy M-Y keletkezik. A koordinációs szám a fémen kettővel növekszik, csakúgy, mint az oxidációs szám és a vegyértékelektronok száma. A 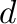 elektronok száma viszont kettővel csökken. Egyik leggyakoribb oxidatív addíciós lépés a molekuláris dihidrogén addíciója egy koordinatíve telítetlen átmenetifém komplexre, így ez a részlépés a H2 aktiválását tartalmazó katalitikus ciklusokban meglehetősen gyakori.
elektronok száma viszont kettővel csökken. Egyik leggyakoribb oxidatív addíciós lépés a molekuláris dihidrogén addíciója egy koordinatíve telítetlen átmenetifém komplexre, így ez a részlépés a H2 aktiválását tartalmazó katalitikus ciklusokban meglehetősen gyakori.
5.7. Ábra:
CH3I oxidatív addíciója Vaska-komplexre (IrCl(PPh3)2(CO)).
|
|
Az oxidatív addíciós reakcióra a 5.7 ábra mutat be egy jellemző példát. A 16 elektronos, síknégyzetes Vaska-komplex oktaéderes 18 elektronos komplexszé alakul át. A reakció gyorsabban megy végbe jodidionok jelenlétében; a I- addíciójával létrejövő anionos komplex nukleofilként viselkedik, és SN2 reakcióban reagál a metil jodiddal, újratermelve a jodid iont.
A szemlélődő ligandumok általában kiszámítható módon hatnak az oxidatív addíció sebességére. Elektronküldő σ-donor ligandumok, mint példálul a trialkilfoszfinok, stabilizálják a koordinatíve telítettebb állapotokat, így a gyakorta előforduló oktaéderes szerkezeteket is.
A reduktív elimináció az oxidatív addíció fordítottja, a vegyértékelektronok száma az oxidációs szám és a koordinációs szám egyaránt kettővel csökken. Bár az oxidatív addíció lejátszódhat főcsoportbeli elemekkel is, az átmenetifémeknél, különösen az elektronegatív nemesfémeknél gyakoribb. Egy katalitikus ciklusban gyakran a reduktív elimináció zárja le a folyamatot, és előáll a végtermék.
Ha a kevés vegyértékelektront (kevesebb, mint 18) tartalmazó komplexet stabilizálni lehet, az elősegíti magát a részlépést is. A ligandumok részéről ilyen hatást érhetnek el a jobb 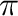 -akceptor és/vagy nagy térkitöltésű ligandumok, továbbá az olyan kelatképzők, melyek nagy kelátszöggel rendelkeznek.
-akceptor és/vagy nagy térkitöltésű ligandumok, továbbá az olyan kelatképzők, melyek nagy kelátszöggel rendelkeznek.
5.8. Ábra:
Alkán reduktív eliminációja Pd(II) komplexről (a), aldehid reduktív eliminációja Rh(IV) dihidrid komplexről (b).
|
|
A szén-szén kötést tartalmazó molekulák reduktív eliminációjánál (5.8 ábra a) az oxidatív addícióhoz hasonló folyamat hiánya annak tudható be, hogy a szén-fém kötések energiája gyakran nem elegendő a szén-szén kötés kialakításához szükséges energiához képest. Továbbá a szén-szén kötések kisebb reaktivitást mutatnak a szén-hidrogén, illetve a hidrogén-hidrogén kötésekhez képest, a taszító kölcsönhatások miatt. Az irodalmi példákban gyakran szerepelnek 10. csoportbeli fémek. A hidrido-acil komplexek reduktív eliminációjához (5.8 ábra b) szintén nem társítható fordított irányú oxidatív addíció a túl magas energiagát miatt; a hidroformilezés irreverzibilis.
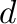 elektronok száma viszont kettővel csökken. Egyik leggyakoribb oxidatív addíciós lépés a molekuláris dihidrogén addíciója egy koordinatíve telítetlen átmenetifém komplexre, így ez a részlépés a H2 aktiválását tartalmazó katalitikus ciklusokban meglehetősen gyakori.
elektronok száma viszont kettővel csökken. Egyik leggyakoribb oxidatív addíciós lépés a molekuláris dihidrogén addíciója egy koordinatíve telítetlen átmenetifém komplexre, így ez a részlépés a H2 aktiválását tartalmazó katalitikus ciklusokban meglehetősen gyakori.
![\includegraphics[width=0.6\textwidth]{elemi/iroxaddch3i}](img127.png)
![\includegraphics[width=0.99\textwidth]{elemi/redelim}](img128.png)