Az egyébként inert, vagyis termodinamikailag stabilis, 100 kcal mol (vagy még nagyobb) kötésdiszociációs energiájú C-H kötések szelektív aktiválása a szintézis során kiválthat egy funkcionalizációs lépést, minimalizálva a gyakran veszélyes hulladékok keletkezését. Az átmenetifém-katalizált C-H aktiválás, nevezetesen a belső szférás C-H hasítás, amely C-átmenetifém kötést hoz létre, környezetbarát és gazdaságilag vonzó stratégia lehet a szerves eljárásokhoz.
(vagy még nagyobb) kötésdiszociációs energiájú C-H kötések szelektív aktiválása a szintézis során kiválthat egy funkcionalizációs lépést, minimalizálva a gyakran veszélyes hulladékok keletkezését. Az átmenetifém-katalizált C-H aktiválás, nevezetesen a belső szférás C-H hasítás, amely C-átmenetifém kötést hoz létre, környezetbarát és gazdaságilag vonzó stratégia lehet a szerves eljárásokhoz.
A C-C kötés szelektív kialakítása az egyébként nem reaktív C-H kötés funkcionalizálásával sok kutatócsoport érdeklődését felkeltette látszólagos egyszerűsége és potenciális gazdasági jelentősége miatt. Az utóbbi pár évtizedben számos C-H aktiválást vizsgáló munka látott napvilágot, a legkülönfélébb átmenetifém-katalizátorokat alkalmazva.
Az átmenetifémen végbemenő C-H aktiválás kapcsán a következő mechanizmusokat szokták megemlíteni: 1) oxidatív addíció elektrongazdag átmenetifémen; 2) 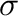 -metatézis korai átmenetifém-tartalmú komplexekkel; 3) elektrofil aktiválás elektronhiányos késői átmenetifémmel. A listát ki szokták még egészíteni egy negyedik mechanizmussal, a bázis által elősegített metallálással. A fenti reakciótípusokat a 16.1 ábra foglalja össze.
-metatézis korai átmenetifém-tartalmú komplexekkel; 3) elektrofil aktiválás elektronhiányos késői átmenetifémmel. A listát ki szokták még egészíteni egy negyedik mechanizmussal, a bázis által elősegített metallálással. A fenti reakciótípusokat a 16.1 ábra foglalja össze.
16.1. Ábra:
Az átmenetifémen végbemenő C-C kötés kialakításához vezető C-H aktiválás lehetséges módjai: 1) oxidatív addíció; 2) 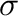 -metatézis; 3) elektrofil szubsztitúció; 4) metallálás bázis segítségével. Piros szín jelzi a fémen kialakuló új kötést, illetve az előzményét
-metatézis; 3) elektrofil szubsztitúció; 4) metallálás bázis segítségével. Piros szín jelzi a fémen kialakuló új kötést, illetve az előzményét
|
|
16.2. Ábra:
Gyűrűzárás elektrofil szubsztitúció jellegű Pd-katalizált C-H aktiválással
|
|
Aréneknél a homogénkatalitikus C-H kötés aktiválás és direkt alkilezés érdekes alternatívája lehet a Friedel-Crafts reakciónak, vagy az alkil-halogenidekkel történő keresztkapcsolási reakcióknak. A 16.2 ábra egy kemoszelektív intramolekuláris gyűrűzárást mutat be. A kondenzált pirroloindolokat eredményező reakcióhoz Pd-monofoszfin rendszereket alkalmaztak.Hwang et al. [2008]
16.3. Ábra:
Aszimmetriacentrum kialakítása közvetett módon, az aromás C-H kötés Pd-katalizált aktiválásával
|
|
A királis indukciónak egy különösen érdekes változatát mutatja be a 16.3 ábra. Hsu és munkatársai Pd(II)-aminosav komplexek segítségével a C-H aktiválást olyan prokirális aromás vegyületen végezték el, ahol nem maga az 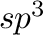 szén volt a reakció célpontja, hanem a rajta lévő két egyenértékű aromás szubsztituens (ezeken kívül jelen van még egy 2-piridil csoport is) közül az egyik orto-helyzetben levő szénatomja. A Suzuki-reakcióhoz hasonlóan az új (alkil) szubsztituens boronsavon keresztül kerül be a rendszerbe. Azonban, amíg ott aril-halogenid aktiválását hajtják végre, addig itt nincs szükség halogénezett aromás vegyületekre. A szerzők a legnagyobb enantioszelektivitást (90% ee) a 16.3 ábrán szereplő aminosav ligandummal érték el.Shi et al. [2008]
szén volt a reakció célpontja, hanem a rajta lévő két egyenértékű aromás szubsztituens (ezeken kívül jelen van még egy 2-piridil csoport is) közül az egyik orto-helyzetben levő szénatomja. A Suzuki-reakcióhoz hasonlóan az új (alkil) szubsztituens boronsavon keresztül kerül be a rendszerbe. Azonban, amíg ott aril-halogenid aktiválását hajtják végre, addig itt nincs szükség halogénezett aromás vegyületekre. A szerzők a legnagyobb enantioszelektivitást (90% ee) a 16.3 ábrán szereplő aminosav ligandummal érték el.Shi et al. [2008]
A C-H aktiválással kapcsolatos újabb eredményeket néhány kiváló összefoglaló mű is feldolgozta az utóbbi időszakban.Rogge et al. [2021], Ackermann [2011]
 (vagy még nagyobb) kötésdiszociációs energiájú C-H kötések szelektív aktiválása a szintézis során kiválthat egy funkcionalizációs lépést, minimalizálva a gyakran veszélyes hulladékok keletkezését. Az átmenetifém-katalizált C-H aktiválás, nevezetesen a belső szférás C-H hasítás, amely C-átmenetifém kötést hoz létre, környezetbarát és gazdaságilag vonzó stratégia lehet a szerves eljárásokhoz.
(vagy még nagyobb) kötésdiszociációs energiájú C-H kötések szelektív aktiválása a szintézis során kiválthat egy funkcionalizációs lépést, minimalizálva a gyakran veszélyes hulladékok keletkezését. Az átmenetifém-katalizált C-H aktiválás, nevezetesen a belső szférás C-H hasítás, amely C-átmenetifém kötést hoz létre, környezetbarát és gazdaságilag vonzó stratégia lehet a szerves eljárásokhoz.
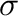
![\includegraphics[width=0.9\textwidth]{chakt/chact_cc}](img276.png)
![\includegraphics[width=0.85\textwidth]{chakt/chact_benzylation}](img277.png)
![\includegraphics[width=0.85\textwidth]{chakt/chact_asymm}](img278.png)