![$\displaystyle \mathrm{C}\xleftarrow{k_1} \mathrm{A} \ce{<=>[K]}\mathrm{B} \xrightarrow{k_2} \mathrm{D}$](img110.png) |
(4.22) |
A Curtin-Hammett elv a szerves kémia és a reakciókinetika egy fontos alapelve, amely különösen releváns olyan esetekben, amikor egy reakció több lehetséges reakcióúton keresztül mehet végbe. Az elv lényege, hogy ha két (vagy több) intermedier (A és B) egyensúlyban van egymással, és ezek az intermedierek különböző sebességgel alakulnak át végtermékekké (C és D) irreverzibilis módon (lásd 4.3. ábra), akkor a végtermékek relatív mennyiségét nem az intermedierek egyensúlyi koncentrációja, hanem az átalakulásuk sebességi állandói határozzák meg.
![$\displaystyle \mathrm{C}\xleftarrow{k_1} \mathrm{A} \ce{<=>[K]}\mathrm{B} \xrightarrow{k_2} \mathrm{D}$](img110.png) |
(4.22) |
Az egyensúlyi folyamathoz tartozik még egy 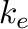 sebességi állandó is, ami legalább egy nagyságrenddel nagyobb, mint a
sebességi állandó is, ami legalább egy nagyságrenddel nagyobb, mint a 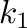 és
és 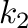 állandók:
állandók:
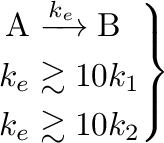 |
![\begin{equation*}\left.\begin{aligned}\frac{d[\mathrm{C}]}{dt}&=k_1[\mathrm{A}] ...
..._2[\mathrm{B}] \approx k_2K[\mathrm{A}]\end{aligned}\right\rbrace\end{equation*}](img115.png) |
![\includegraphics[width=0.9\textwidth]{kinetika/curtinhammett}](img116.png)
|
A két koncentráció aránya az egyensúlyi és sebességi állandókkal kifejezve:
![$\displaystyle \frac{[\mathrm{D}]}{\mathrm{[C}]}\approx \frac{\frac{d[D]}{dT}}{\...
...B}]}{k_1[\mathrm{A}]}=\frac{k_2K[\mathrm{A}]}{k_1[\mathrm{A}]}=\frac{k_2K}{k_1}$](img117.png) |
(4.25) |
![$\displaystyle \frac{[\mathrm{D}]}{[\mathrm{C}]}\approx \frac{e^\frac{-\Delta G_...
..._1^\ddag }{RT}}=e^{-\frac{\Delta G_2^\ddag -\Delta G_1^\ddag + \Delta G^0}{RT}}$](img118.png) |
(4.26) |
A Curtin-Hammett elv lényege tehát egy képletbe összefoglalva:
![$\displaystyle \frac{[\mathrm{D}]}{[\mathrm{C}]}\approx e^{-\dfrac{\Delta \Delta G^\ddag }{RT}}$](img119.png) |
(4.27) |
A Curtin-Hammett elv számos később tárgyalt katalitikus reakciónál kap fontos szerepet (pl. olefin hidrogénezés, hidroformilezés). Egyéb példaként megemlíthetjük még a dinamikus kinetikus rezolválást, amit szintén ezen elv alapján lehet értelmezni.Chalker et al. [2024]