A „katalízis” kifejezést Jöns Jakob Berzelius alkotta meg több mint 150 évvel ezelőtt, amikor észrevette, hogy bizonyos anyagok kis mennyiségű, "fermentumoknak" nevezett anyagokkal való érintkezéskor változásokon mennek keresztül. Sok évvel később, 1895-ben Ostwald olyan definícióval állt elő, amelyet többé-kevésbé a mai napig használunk: a katalizátor olyan anyag, amely megváltoztatja egy kémiai reakció sebességét anélkül, hogy maga megjelenne a termékekben. Ez azt jelenti, hogy Ostwald szerint egy katalizátor lassíthatja is a reakciót! A ma használt meghatározás így hangzik: a katalizátor olyan anyag, amely növeli annak a sebességét, hogy egy kémiai reakció egyensúlyba kerüljön anélkül, hogy maga tartósan részt venne benne.
A homogén katalízis definíció szerint olyan katalitikus rendszerre utal, amelyben egy reakció szubsztrátjait és a katalizátor komponenseit egy fázisban, legtöbbször a folyadékfázisban, hozzák össze. Az utóbbi időben divatossá vált egy szűkebb definíció, amely szerint a homogén katalízis (szerves) fémkomplexeket foglal magában katalizátorként. Szigorúan véve egy szerves fémvegyületnek tartalmaznia kellene egy szén- és egy fématom közötti kötést, de ez nem igaz minden megvitatásra kerülő katalizátorra. Ebben a könyvben kizárólag az átmenetifém-katalizátorokra épülő homogénkatalitikus reakciókról lesz szó, de érdemes figyelembe venni, hogy sok érdekes és fontos reakció alkalmaz olyan homogén katalizátorokat, amelyek nem (szerves) fémkomplexek. Ilyen rendszerek vagy katalizátorok például:
- általános sav- és báziskatalízis (észterhidrolízis),
- Lewis-savak katalizátorként (Diels-Alder reakciók),
- frusztrált Lewis-párok (hidrogénezés),
- organokatalizátorok (pl. cikloaddíciós reakciók),
- porfirinkomplexek (epoxidációk, hidroxilezések),
- enzimatikus folyamatok
A legősibb homogén katalizátorok kétségtelenül a metalloenzimek, bár felmerülhet a kérdés, hogy egy nagy molekulatömegű fehérjébe beépített fémkomplex valóban homogén-e egy sejten belüli kapszulában. Ha a válasz igen, az azt jelenti, hogy a homogén katalizátorok sokmillió évesek! Itt most nem térünk ki részletesen rájuk, csak néhány példát említünk, mint például a vas-porfirin komplexek, amelyek aktívak az oxidációban, a cinkkomplexek a dekarboxilező reakciókban és az alkohol-dehidrogenázban, a nikkelkomplexek a hidrogénáz enzimekben a hidrogén aktiválásához, a kobalt-korin (metil-kobalamin) komplexek a szén-szén kötés kialakításához, és a réz-imidazol (a hisztidinből) komplexek a hemocianinban. Az egyik legrégebbi in vitro teljes sejtekkel történő alkalmazás valószínűleg a szőlőcukor alkohollá történő erjedésére való élesztő használata lehetett.
Elképzelhető, hogy az ember által készített legrégebbi katalizátorok heterogének voltak, de lehet, hogy mégsem ez a helyzet. Nagyon régi katalitikus folyamat a kénsav készítése az ún. „ólomkamrás eljárással” ( 1750), amelyben a nitrogén-oxidok kénsavas gőzt oxidálnak trioxiddá, és a NO-t ismét NO2-vé reoxidálja a levegő. Így a NO/NO2 nitrózus gázok a katalizátorok, és mivel mindezek a gázfázisban mennek végbe, ezért itt elvileg homogén katalízisről van szó.
1750), amelyben a nitrogén-oxidok kénsavas gőzt oxidálnak trioxiddá, és a NO-t ismét NO2-vé reoxidálja a levegő. Így a NO/NO2 nitrózus gázok a katalizátorok, és mivel mindezek a gázfázisban mennek végbe, ezért itt elvileg homogén katalízisről van szó.
A XIX. század vége felé, 1870-től kezdve számos heterogénkatalitikus folyamatot fedeztek fel. A legelső iparilag alkalmazott, oldatban működő katalizátor, amely szerves-fém intermediereket használt, valószínűleg a higany-szulfát volt, amelyet az 1920-as években használtak az acetilén acetaldehiddé történő átalakítására. Ez az acetilénhez víz hozzáadását jelenti; nem volt külön oxidációra szükség. Iparilag ez az elődje a Wacker-eljárásnak, amely az etilén oxidatív átalakításával állít elő acetaldehidet. Ez a változás akkor következett be, amikor az 1950-es években a szénalapú gazdaság (szénből acetilén, elektromos ívkemencében) olajra váltott.
Az 1950-es években beindult második folyamat az etén oligomerizációja volt kobalt komplexek felhasználásával, de az 1960-as évekig a homogénkatalitikus reakciók száma alacsony maradt, bár további négy folyamat indult el útjára. Nevezetesen a nikkel-katalizált hidrociánozás (DuPont), a kobalt-katalizált metanol karbonilezés (BASF), a kobalt-katalizált hidroformilezés (Shell) (amelyet már 1938-ban Otto Roelen fedezett fel), és a propén molibdén-katalizált epoxidációja (Halcon Corporation). A hetvenes évektől kezdve a homogén katalizátorok aránya olyan sikertörténetekkel növekedett, mint a metanol ródium katalizált karbonilezése (Monsanto), a ródium katalizált hidroformilezés (Union Carbide Corporation, Wilkinson eredményeinek felhasználásával), a Shell által kifejlesztett hosszabb szénláncú olefinek előállítása ('higher olefin process'), az L-DOPA szintézise aszimmetrikus hidrogénezéssel (Monsanto), és a ciklooktén gyűrűnyitó polimerizációja volfrám metatézis katalizátorokkal (Huels).
A homogén folyamatok többségét tömegtermékekhez fejlesztették ki, mivel csak az elegendő mennyiségben forgalomba kerülő termékek tudták indokolni az új katalizátorok és a hozzájuk kapcsolódó mérnöki fejlesztések költségeit. Csak a kilencvenes években indultak el alkalmazások a finomkémiai területen, kihasználva a nagy volumenű eljárások területén kapott kutatási eredményeket és az akadémiai körökben addigra felhalmozott tudásanyagot.
Kezdjük azzal, hogy meghatározunk néhány kulcsfontosságú fogalmat.
A reaktánsok vagy reagensek olyan anyagok, melyek a kémiai folyamat megkezdésekor már jelen vannak a reakcióedényben és a reakció során részben, vagy teljes egészében elfogynak.
A termék a reakció kezdetekor nincs jelen, hanem a kémiai reakció során keletkezik és halmozódik fel.
A katalizátort jellemzően más formában, katalizátor prekurzorként adjuk hozzá a reaktánsokhoz, amelyet aktív formába kell hozni („aktiválni”). A katalitikus ciklus során, ha a molekuláris szintet vizsgáljuk, a katalizátor több köztes formában is jelen lehet. Az aktív katalizátor többször is végigjárja ezeket az állapotokat; ebben az értelemben a katalizátor változatlan marad. Azon katalizátorok száma, amelyek végigjárják a teljes ciklust, lesz az átalakítási szám (Turnover Number, TON). Az átalakítási frekvencia (Turnover Frequency, TOF) az átalakítási szám egy adott időegységre vonatkoztatva. A szubsztrátumok nagyobb mennyiségben vannak jelen, mint a katalizátorok; ezért a katalitikus reakciók során a szubsztrátum/katalizátor arány is fontos mutató.
Az inhibitor olyan anyag, amely lelassít egy reakciót. Az inhibitor is „katalitikus”, azaz a reakcióhoz képest alacsony vagy szubsztöchiometrikus mennyiségben van jelen. Egy gyökös láncreakcióban például az inhibitor lehet egy gyökfogó, amely megszakítja az események láncolatát. Egy fémkatalizált reakcióban az inhibitor lehet egy olyan anyag, amely a fémhez túl erősen koordinálódik, ezáltal kevésbé aktívvá teszi vagy blokkolja a szubsztrátnak szánt koordinációs helyet. Beszélünk még mérgezésről is, amely egy katalitikus reakciót teljesen leállító anyag jelenlétében következhet be. Gyakran találkozhatunk a „ko-katalizátor” kifejezéssel is, amely egy olyan komponenst jelent, amely a katalizátor részét képezi, vagy valamilyen lényeges szerepe van a katalitikus ciklus valamely pontján. Elődeinktől örököltünk egy gazdag nyelvezetet, akiknek a katalízis még egyfajta fekete mágia volt. Természetesen ezek a kifejezések nem túl pontosak a katalízis leírásához molekuláris szinten.
A fémorganikus katalizátorok központi fémből és szerves (valamint szervetlen) ligandumokból állnak, amelyek körbeveszik a fémcentrumot. A katalizátor tulajdonságait mind a fém, mind a különféle ligandumok meghatározzák. Az átmenetifém-alapú katalizátorok sikerének egyik oka a katalizátor viszonylag könnyű módosíthatóságában rejlik, amelyet a ligandumkörnyezet megváltoztatásával érhetünk el. A kulcsfontosságú tulajdonságok között szerepel a reakció sebessége és a kívánt termékekkel szembeni szelektivitás.
A katalitikus reakciókban jellemzően az alábbi szelektivitás típusokat különböztetjük meg. Az 2.1 ábra ezt hivatott illusztrálni.
2.1. Ábra:
Szelektivitás típusai a hidroformilezés (és hidrogénezés, mint mellékreakció) példáján bemutatva.
|
|
- Kemoszelektivitás: Amikor a reakció két, kémiailag különböző funkciós csoportot tartalmazó terméket eredményezhet, mint ahogy a 2.1 ábrán bemutatott példában látható, tehát a vinil csoport vagy hidrogéneződik, vagy formil csoport kerül kialakításra, akkor a kívánt termék (ebben az esetben az aldehid), és az összes keletkező termék koncentrációjának a hányadosa a kemoszelektivitást adja meg.
- Regioszelektivitás: Ahogy azt a hidroformilezési reakcióra vonatkozó példában bemutatjuk, a formilcsoport a primer, terminális szénatomhoz vagy a szekunder, belső szénatomhoz kapcsolódhat, amely rendre a lineáris és az elágazó terméket eredményezi. A regioszelektivitást meg lehet adni a lineáris, vagy az elágazó termékre, de regioszelektivitás közlésekor ezt mindenképpen pontosítani kell.
- Enantioszelektivitás: Ebben az esetben a szubsztrát akirális (pontosabban prokirális), de az enantiomerikusan tiszta katalizátor előidézheti egy adott termékenantiomer képződését. Az egyéb szelektivitás értékektől eltérően az enantioszelektivitást többnyire enantiomerikus többlet formájában szoktuk megadni (ee). Például az
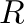 enantiomerre a következőképpen:
enantiomerre a következőképpen:
![$\displaystyle ee=\frac{[R]-[S]}{[R]+[S]}$](img13.png) |
(2.1) |
Értelemszerűen a nagy szelektivitás elérése lényeges a keletkezett hulladékok csökkentése, így az egyszerűbb termékfeldolgozás szempontjából.
A katalitikus reakcióknál néha több nagyságrenddel növelhetők a reakciósebességek, gyakran nagyon finom változtatások alkalmazásával. A sebességek költségtényezőt jelentenek; nagyobb sebességekkel nagyobb térfogat-idő hozamok érhetők el (termék kg-ja idő és reaktortérfogat alapján), így elvileg kisebb reaktorokra van szükség. A nagyobb sebességek és a kedvezőbb teljes katalizátorhoz viszonyított hozamok (azaz a termék tömege katalizátor egységtömegre vetítve) csökkentik a katalizátorköltségek arányát a keletkezett termék egységtömegére vetítve. Például az olefin polimerizációhoz használt metallocén katalizátorok esetében ezeknek a katalizátoroknak a magasabb katalizátorköltség-hozzájárulása jelentősen csökkentette hatásukat és az esélyt, hogy ki tudják szorítani a Ziegler-Natta katalizátorokat (ahol a katalizátorköltség-hozzájárulás kevesebb, mint a negyede volt az előbbinek).
Megjegyzendő, hogy a vegyiparban, a nagyobb volumenű folyamatoknál a katalizátor aktivitásánál is fontosabb szempont, hogy a reakció exoterm legyen. Ugyanis még ha viszonylag nagyobb hőmérsékletre fel is kell fűteni a reaktort, a reakció során keletkező hő viszont “ingyen” energiának számít, amit számos ponton lehet hasznosítani.
Mielőtt a részletekre rátérnénk, egy-két egyszerű példán keresztül nézzük meg, hogyan működik egy katalizátor. Refluxolhatunk karbonsavakat és alkoholokat, és semmi nem történik, amíg nem adunk hozzá nyomokban ásványi savat, amely katalizálja az észterképződést. Tárolhatunk etént palackban évekig (amíg a palack teljesen el nem rozsdásodik) anélkül, hogy polietilén képződne, annak ellenére, hogy utóbbi képződése több mint 80 kJ/mol-lal exoterm. Melegíthetünk metanolt és szén-monoxidot 250 °C-on és 600 bar CO nyomáson anélkül, hogy ecetsav képződne. Miután hozzáadtuk a katalizátort, a kívánt termékek nagy sebességgel keletkeznek.
Egy katalizátor csökkenti egy reakció aktiváláshoz szükséges, energia mértékegységben kifejezhető korlátját, azaz csökkenti az aktiválási energiát. Amikor mondjuk protonok vagy Lewis-savak a katalizátorok, ez a leírás pontosnak tűnik, például egy Diels-Alder reakció esetében. A katalizátor elektrofilabbá teszi a dienofilt, csökkenti a LUMO (legalacsonyabb energiájú betöltetlen molekulapálya) energiaszintjét, és így felerősíti a dienofil LUMO-ja és a dién HOMO-ja (legnagyobb energiájú betöltött molekulapálya) közötti kölcsönhatást. Ennek eredményeként a katalizátor jelenlétében lejátszódó reakció gyorsabbá válik, mint a nem katalizált. (Szerencsés véletlen, hogy ezáltal még regioszelektívebb is lesz.) Ebben az esetben a katalizált reakció hasonló a nem katalizálthoz.
Gyakran viszont a reagensek teljesen reakcióképtelenek egymással szemben (etén az eténnel, metanol a szén-monoxiddal, lásd fent), tehát az kép, miszerint a katalizátor csökkenti a reakció energiakorlátját, leegyszerűsítés.
A következő leírás kicsit általánosabb és összetettebb. A katalizátor vonzóbb reakcióutat biztosít a reagensek számára annak érdekében, hogy a termékekhez eljussanak. Ez az új útvonal akár több lépést is foglalhat magában, és meglehetősen bonyolult is lehet. Képzeljük el ismét a metanol és a CO közvetlen reakcióját. Kvantumkémiai módszerek segítségével kiszámíthatjuk, hogy a termikus reakció legvalószínűbb útvonala hogyan néz ki. Elképzelhető, hogy a metil-hidroxil kötés majdnem teljes disszociációja szükséges, mielőtt a CO elkezdene kölcsönhatásba lépni a metanol fragmenssel. (A reakcióhoz szükséges hőmérséklet lehetővé teszi a metán és a CO energetikailag kedvezőbb képződését is!) A katalitikus reakció (Monsanto-eljárás) viszont magában foglalja a metil-jodid képződését, a metil-jodid reakcióját egy ródiumkomplexszel, a metil-ródium fragmens reakcióját a koordinált szén-monoxiddal stb., ami nem éppen a legegyszerűbb és legközvetlenebb útvonal, amit el tudnánk képzelni. És mégis ez a reakcióútvonal az összetett katalitikus folyamat alapja, melynek során a katalizátor reaktív állapotban hozza össze a reagenseket. A katalizátor tehát egy új, alacsony aktiválási energiagáttal rendelkező reakcióutat biztosíthat, amely több köztiterméket és ezáltal több lépést foglalhat magában. A lépéssorozatot reakciómechanizmusnak nevezzük. A katalitikus ciklus során a katalizátor több komplex vegyületté alakul át, azonban a termék különválásakor (elimináció) visszakapjuk a katalitikus ciklust záró komplexet. Ebben az értelemben a katalizátor maga változatlan marad a katalitikus átalakulás során.
A ligandumok és azok hatásai rendkívül fontosak a az átmenetifém-komplexek homogénkatalitikus reakcióiban. Sokszor a fém központi atomhoz kapcsolódó ligandumok variálásával a reakció kimenetelét alapvető módon tudjuk befolyásolni. Ha butadiént például allil-nikkel(II)-komplexek jelenlétében reagáltatunk, polimereket kapunk. Nikkel(0) prekurzor esetén viszont 'all-transz' trimereket kapunk (pl. ciklododekatrién). Ha a Ni(0) katalizátor trifenilfoszfinnal módosítjuk, akkor viszont már ciklooktadién lesz a termékünk.
 1750), amelyben a nitrogén-oxidok kénsavas gőzt oxidálnak trioxiddá, és a NO-t ismét NO2-vé reoxidálja a levegő. Így a NO/NO2 nitrózus gázok a katalizátorok, és mivel mindezek a gázfázisban mennek végbe, ezért itt elvileg homogén katalízisről van szó.
1750), amelyben a nitrogén-oxidok kénsavas gőzt oxidálnak trioxiddá, és a NO-t ismét NO2-vé reoxidálja a levegő. Így a NO/NO2 nitrózus gázok a katalizátorok, és mivel mindezek a gázfázisban mennek végbe, ezért itt elvileg homogén katalízisről van szó.
![\includegraphics[width=1.05\textwidth]{elemi/selectivities}](img11.png)
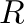
![$\displaystyle ee=\frac{[R]-[S]}{[R]+[S]}$](img13.png)