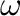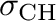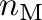Egy katalitikus reakció hatékonysága nagymértékben függ a helyes fém és a helyes ligandum(ok) megválasztásától. Említettük, hogy homogén katalízis nem kizárőlag az átmenetifém-katalizált folyamatokról szól, ezek aránya és jelentősége azonban domináns az egyéb homogénkatalitikus reakciókhoz képest.
Felvetődhet az a kérdés, hogy mi olyan különleges az átmenetifémekben, ami miatt az azokat tartalmazó katalizátorrendszerek ilyen kiemelt fontosságra tettek szert. Miért találunk a főcsoportbeli elemekre épülő rendszerek között nagyságrendekkel kevesebb hatékony katalitikus rendszert? Nos, erre a kérdésre a válasz az átmenetifémek lényegesen nagyobb variálhatóságában rejlik. Ráadásul, ez a variálhatóság is több tényezőre bontható szét.
Az oxidációs szám rugalmassága. Egy katalitikusan aktív komplexben az oxidációs szám könnyen változhat a katalitikus ciklus egyes lépései során. Jellemző mintázat a 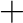 2/−2 változás, mint például a palládiumkatalizált kapcsolási reakciók esetén, amikor is az aktív katalizátor Pd(0), azonban a ciklus nagyrészt Pd(II) komplexeken keresztül megy végbe, és bizonyos esetekben még a Pd(IV) komplexek jelenléte sem zárható ki.
2/−2 változás, mint például a palládiumkatalizált kapcsolási reakciók esetén, amikor is az aktív katalizátor Pd(0), azonban a ciklus nagyrészt Pd(II) komplexeken keresztül megy végbe, és bizonyos esetekben még a Pd(IV) komplexek jelenléte sem zárható ki.
Vegyértékelektronszám-változás. Az átmenetifém komplexek a telített, 18 vegyértékelektront tartalmazó formájuk mellett gyakran 16-, sőt, 14-elektronos formában is előfordulnak. Utóbbiak jellemzően a nagy reakcióképességű intermedierek között találhatók meg, azonban a 16 elektronos komplexek közül számos stabilis, akár kipreparálható komplexet ismerünk, elsősorban a 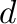 -mező jobb alsó részében található fémek (Rh, Pd, Ir, Pt) származékaiként.
-mező jobb alsó részében található fémek (Rh, Pd, Ir, Pt) származékaiként.
Koordinációs szám változása. Ligandumok disszociációjával és asszociációjával könnyen és rugalmasan változhat a koordinációs szám, ami lehetővé teszi a szubsztrátumok könnyű koordinációját és továbbalakítását a fém koordinációs övezetében. A szinte zavarba ejtően változatos ligandumcserére a 3.1. ábra szolgáltat egy példát, melynél a telített, tetrakisz(trifenilfoszfin)palládium(0) komplex ligandumcsere reakcióit, ezáltal a karbonilatív kapcsolási reakciókra alkalmas katalizátorok kialakulását láthatjuk, szén-monoxid jelenlétében.Pálinkás et al. [2017]
3.1. Ábra :
Variációs lehetőség a Pd(PPh3)4 komplexből kiindulva trifenilfoszfin és a szén-monoxid jelenlétében.
|
|
Speciális kötéstípusok. Amikor kovalens kötésről beszélünk, akkor jellemzően egy (vagy több) elektronpárra gondolunk, melyek két atomot kötnek össze. A hagyományos értelemben vett kovalens kötésnél ezen pár egyik elektronja az egyik, a másik a másik kötést létesíteni kívánó atomtól származik. Ilyen fajta (az angol nyelvű szakirodalomban 'shared shell') kovalens kötés létezik az átmenetifém komplexeknél is, azonban rájuk sokkal jellemzőbb a 'closed-shell', azaz a donor-akceptor kölcsönhatás, amikor is a kötést létrehozó elektronpár teljes egészében az egyik atomtól származik. Egyszerűbb esetnek számít az, amikor egy olyan ligandum, mint egy (formálisan anionos) alkil csoport ad át elektronpárt a fémnek, “tiszta” 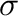 -donor kölcsönhatást kialakítva vele.
-donor kölcsönhatást kialakítva vele.
Ennél összetettebb (és gyakoribb) a donor-akceptor kölcsönhatásra épülő koordinációs kötés. A ligandumtól származó elektronpáron kívül ilyenkor a fémről a ligandum felé irányuló viszontkoordinációs kölcsönhatás is jelentős szerepet kap. Attól függően, hogy a ligandum 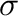 vagy
vagy 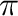 szimmetriájú donor kölcsönhatást képes létesíteni, beszélhetünk
szimmetriájú donor kölcsönhatást képes létesíteni, beszélhetünk 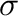 -donor vagy
-donor vagy 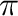 -donor kölcsönhatásról. A viszontkoordináció jellemzően a fém valamelyik
-donor kölcsönhatásról. A viszontkoordináció jellemzően a fém valamelyik 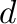 pályájáról indul és irányul a ligandum
pályájáról indul és irányul a ligandum 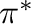 lazító pályájára. Az ilyen jellegű kölcsönhatásokra leginkább az alkének
lazító pályájára. Az ilyen jellegű kölcsönhatásokra leginkább az alkének 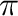 -donor/
-donor/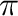 -akceptor (Dewar-Chatt-Duncanson modell, 3.2 ábra a.) és a szén-monoxid
-akceptor (Dewar-Chatt-Duncanson modell, 3.2 ábra a.) és a szén-monoxid 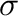 -donor/
-donor/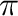 -akceptor kölcsönhatását (3.2 ábra b.) szokás elsőként megemlíteni. Az utóbbi típusba szokták néha sorolni a foszfinok és egyéb P-donor ligandumok fémekkel megvalósuló kölcsönhatását is, mivel kétségtelenül található analógia a foszfinok és a szén-monoxid kölcsönhatásai között. (Mindkettő, mint Lewis-bázis, hasonló jellegzetességgel bír, pl. boránszármazékokkal előszeretettel képeznek töltésátviteli komplexeket.) Történeti okai is vannak a
-akceptor kölcsönhatását (3.2 ábra b.) szokás elsőként megemlíteni. Az utóbbi típusba szokták néha sorolni a foszfinok és egyéb P-donor ligandumok fémekkel megvalósuló kölcsönhatását is, mivel kétségtelenül található analógia a foszfinok és a szén-monoxid kölcsönhatásai között. (Mindkettő, mint Lewis-bázis, hasonló jellegzetességgel bír, pl. boránszármazékokkal előszeretettel képeznek töltésátviteli komplexeket.) Történeti okai is vannak a 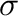 -donor/
-donor/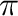 -akceptor besorolásnak: a nyolcvanas évek elejét megelőzően még élt egy olyan hiedelem, hogy a 3. periódus főcsoportbeli elemeinél már a
-akceptor besorolásnak: a nyolcvanas évek elejét megelőzően még élt egy olyan hiedelem, hogy a 3. periódus főcsoportbeli elemeinél már a 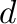 -pályák is bekapcsolódhatnak a kölcsönhatásokba, akceptorként. Mostanra azonban már teljesen elfogadottá vált, hogy a P-C (vagy P-O, P-H, stb.)
-pályák is bekapcsolódhatnak a kölcsönhatásokba, akceptorként. Mostanra azonban már teljesen elfogadottá vált, hogy a P-C (vagy P-O, P-H, stb.) 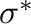 pályák viselkednek akceptorként (3.2 ábra c.), és a viszontkoordináció erőssége gyengébb, mint az alkének és a karbonil komplexek esetében.
pályák viselkednek akceptorként (3.2 ábra c.), és a viszontkoordináció erőssége gyengébb, mint az alkének és a karbonil komplexek esetében.
3.2. Ábra :
Jellemző donor-akceptor kölcsönhatások
|
|
A 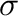 -donor kölcsönhatások egy speciális esete a ligandumként viselkedő dihidrogén molekulához köthető (3.2 ábra d.). A donor elektronpár a H-H
-donor kölcsönhatások egy speciális esete a ligandumként viselkedő dihidrogén molekulához köthető (3.2 ábra d.). A donor elektronpár a H-H 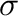 -kötés (nincs nagy választék), azonban a korábban említettektől eltérően itt a koordináció iránya merőleges a kötés tengelyéhez képest (az angol szakirodalomban ezt 'side-on' koordinációnak hívják.) A viszontkoordináció akceptor pályájaként a dihidrogén
-kötés (nincs nagy választék), azonban a korábban említettektől eltérően itt a koordináció iránya merőleges a kötés tengelyéhez képest (az angol szakirodalomban ezt 'side-on' koordinációnak hívják.) A viszontkoordináció akceptor pályájaként a dihidrogén 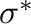 pályája szolgál, ami lazító pálya: ennek megfelelően a H2 ligandumban megtalálható kötéstávolság nagyobb a szabad molekulához képest. Természetesen a kötéstávolság-növekedésnek az is az oka, hogy a kötőpálya elektronsűrűséget ad át a fématom egy üres (pontosabban alacsony populációjú) pályájának, így szintén csökkenni fog a kötéserősség.
pályája szolgál, ami lazító pálya: ennek megfelelően a H2 ligandumban megtalálható kötéstávolság nagyobb a szabad molekulához képest. Természetesen a kötéstávolság-növekedésnek az is az oka, hogy a kötőpálya elektronsűrűséget ad át a fématom egy üres (pontosabban alacsony populációjú) pályájának, így szintén csökkenni fog a kötéserősség.
A síknégyzetes és oktaéderes átmenetifém komplexeknél nem ritka a 3-centrumos, 4-elektronos kötés, amit 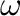 kötésnek is szoktak hívni. Ez tulajdonképpen két nagyjából egyenlő valószínűséggel előforduló Lewis-határszerkezet eredője, amiben mindkét oldalon egy-egy donor-akceptor kölcsönhatás szerepel.
kötésnek is szoktak hívni. Ez tulajdonképpen két nagyjából egyenlő valószínűséggel előforduló Lewis-határszerkezet eredője, amiben mindkét oldalon egy-egy donor-akceptor kölcsönhatás szerepel.
Az agosztikus kölcsönhatás jellemzően koordinatíve telítetlen fémkomplexekben fordul elő a fém és egy hidrogént tartalmazó ligandum (általában alkil csoport) kölcsönhatása formájában. Tulajdonképpen az agosztikus kölcsönhatás is felfogható donor-akceptor kölcsönhatásként: a
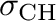 kötés a donor pálya, míg az akceptor a fémnek egy egycentrumos alacsony populációjú pályája (
kötés a donor pálya, míg az akceptor a fémnek egy egycentrumos alacsony populációjú pályája (
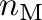 ). Az agosztikus kölcsönhatásnak fontos szerepe van az alkil-komplexeket tartalmazó katalitikus folyamatokban, mint például az alkén polimerizáció, az alkén hidrogénezés, vagy hidroformilezés.
). Az agosztikus kölcsönhatásnak fontos szerepe van az alkil-komplexeket tartalmazó katalitikus folyamatokban, mint például az alkén polimerizáció, az alkén hidrogénezés, vagy hidroformilezés.
Alfejezetek
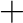 2/−2 változás, mint például a palládiumkatalizált kapcsolási reakciók esetén, amikor is az aktív katalizátor Pd(0), azonban a ciklus nagyrészt Pd(II) komplexeken keresztül megy végbe, és bizonyos esetekben még a Pd(IV) komplexek jelenléte sem zárható ki.
2/−2 változás, mint például a palládiumkatalizált kapcsolási reakciók esetén, amikor is az aktív katalizátor Pd(0), azonban a ciklus nagyrészt Pd(II) komplexeken keresztül megy végbe, és bizonyos esetekben még a Pd(IV) komplexek jelenléte sem zárható ki.
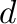
![\includegraphics[width=0.89\textwidth]{ligands/pdpph3cocsere}](img17.png)
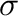
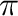
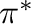
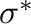
![\includegraphics[width=1.0\textwidth]{ligands/donorakceptor}](img21.png)