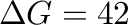 kJ mol
kJ mol ), és közel van ahhoz a tapasztalati korláthoz, aminél nagyobb reakciószabadentalpia esetében már nem nagyon van esély katalitikus alkalmazásokra sem.
), és közel van ahhoz a tapasztalati korláthoz, aminél nagyobb reakciószabadentalpia esetében már nem nagyon van esély katalitikus alkalmazásokra sem.
A vízgáz-shift reakciót (WGSR) a 9.4 fejezetben tárgyaltuk, és a 9.2 egyenlet megtekintésekor láthattuk, hogy a reakció enyhén exergonikus. Ez egyben azt jelenti, hogy a fordított irány endergonikus (
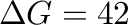 kJ mol
kJ mol ), és közel van ahhoz a tapasztalati korláthoz, aminél nagyobb reakciószabadentalpia esetében már nem nagyon van esély katalitikus alkalmazásokra sem.
), és közel van ahhoz a tapasztalati korláthoz, aminél nagyobb reakciószabadentalpia esetében már nem nagyon van esély katalitikus alkalmazásokra sem.
Tapasztalatok szerint, ahhoz, hogy fordított vízgáz-shift reakció működni tudjon, rendkívül elektrondús fémcentrumra van szükség, hogy a szén-dioxid szénatomját a fém úgy tudja támadni, hogy az eredmény egy fém-karboxilát közti termék legyen. A másik lehetséges útvonalat a 17.5 ábra mutatja be, ahol a szén-dioxid a fém-hidrid kötésbe ékelődik be, formiáto-komplexet képezve, amit CO kiválás követ, majd a ciklus záró lépése a fém-hidroxi egység hidrogéneződése dihidrogénnel.
A fordított vízgáz-shift reakció jelentőségét az adja, hogy a szén-dioxid karbonilezési reakciókban CO-helyettesítőként szolgálhat. A szén-monoxid a szén-dioxidnál ugyanis jóval drágább, speciális gázpalackot igényel (acél palackokban nem lehet tárolni, mert a lassan de folyamatosan keletkező vas-pentakarbonil az idők során “megeszi” a palackot), és mindenekelőtt mérgező.
Tominaga és Sasaki 2000-től kezdtek publikálni olyan eredményeket, ahol alkének hidroformilezését CO2/H2 gázeleggyel végezték el.Tominaga and Sasaki [2000]
Katalizátorrendszerként a lítium-kloriddal adagolt Ru3(CO)12 komplexet alkalmazták viszonylag magas hőmérsékleten (140 ). A reakció jellegzetessége, hogy a kinyerhető termékek alkoholok, mivel az aldehidek C=O kötését a ruténium katalizátor készségesen tovább hidrogénezi. Példaként a ciklohexén hidroformilezését mutatjuk be a 17.6 ábrán. Látható, hogy az aldehidek aránya itt mindössze 3% volt. A főtermék alkoholon kívül ennél a típusú reakciónál gyakran keletkeznek nagyobb arányban kondenzációs termékek.
Többen vizsgálták a halogenidsó kokatalizátor szerepét, és megállapították, hogy a halogenid ionnak elengedhetetlen szerepe van a nagyobb aktivitású katalizátorok kialakításában. Az aktivitási sorrand Cl- 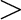 Br-
Br- 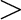 I-, a Li ionnak csak annyiban van jelentősége, hogy jobban oldódik szerves fázisban.
I-, a Li ionnak csak annyiban van jelentősége, hogy jobban oldódik szerves fázisban.
Alkén, szén-dioxid és hidrogén katalitikus reakciójában keletkezhetnek karbonsavak is. Ezt a reakciótípust is hidrokarboxilezésnek nevezzük, azonban eltérően a szén-monoxidot felhasználó reakciótól, itt dihidrogén a hidrogén forrás, nem pedig víz. A 17.6 ábrán látható reakcióval analóg esetet mutat be a 17.7 ábra, ahol a hasonló körülmények ellenére nem alkohol, hanem karbonsav lesz a termék.
A katalizátortól (fémtól és ligandumoktól), valamint a reakciókörülményektől függően a CO2-alapú hidrokarboxilezés esetén háromféle mechanizmust szoktak elkülöníteni. Az elsőnél az alkén és a CO2 oxidatív kapcsolással 5-tagú metallalakton közti terméket képez, mely hidrogenolízissel szolgáltatja a karbonsav terméket.
A második mechanizmus esetén fém-hidrid reagál az alkénnel és a vándorlásos beékelődés fém-alkil komplexet eredményez. Ezt követi a CO2 beékelődése a fém-alkil kötésbe, majd a hidrogenolízis fém-hidridet és karbonsavat eredményez.
A harmadik mechanizmusnál szintén kialakul az alkil komplex, de az a fordított vízgáz-shift reakcióban létrejövő szén-monoxiddal reagál és képez acil komplexet, amiből hidrolízissel kapjuk meg a fém-hidridet és a karbonsav terméket.