![\includegraphics[width=1.05\textwidth]{hidrogen/ldopadipamp}](img247.png)
|
Jelentőségét tekintve kétségtelenül kimagaslik az enantioszelektív homogénkatalitikus reakciók közül egy bizonyos királis aminosav, az L-DOPA, más néven levodopa előállítása, melynek igen fontos szerepe van a Parkinson-kór kezelésében.
A Parkinson-kórnál alapvető terápiás cél az agyi dopaminszint növelése. Közvetlenül dopamint nem lehet azonban adagolni, mert az, túl poláros molekula révén, nem tud áthatolni a vér-agy gáton. A levodopa ezzel szemben be tud jutni a központi idegrendszerbe, és a dopamin dekarboxileződéssel keletkezik belőle, a DOPA-dekarboxiláz (DDC) enzim hatására.
A katalitikus eljárás jelentőségét mutatja, hogy annak kifejlesztője, William S. Knowles, 2001-ben megosztva kémiai Nobel-díjat vehetett át az aszimmetrikus hidrogénezés területén végzett munkásságáért.
A reakció alapvetően a 13.3 mechanizmus szerint megy végbe, ahol a szubsztrátum a védőcsoportokkal ellátott prokirális fahéjsavszármazék énamid, amit többlépéses szintézissel állítanak elő 3,4-pozíciókban helyettesített benzil-bromidból és dietil-acetamido-malonátból.
A (1)-(2) lépéseket, illetve az itt keletkező Rh(III)-dihidridek arányát a Curtin-Hammett kinetika határozza meg. Noha a si,si-oldalt koordinálódó komplex nagyobb termodinamikai stabilitású, mint a re,re közti termék, utóbbi mégis gyorsabban reagál a dihidrogénnel a (2) lépésben.
Megemlítendő, hogy a difoszfin (és a belőle képezett Rh-komplex) C2 szimmetriája a lehetséges 4 diasztereomer számát lecsökkenti kettőre. Nagyon fontos szerepet tölt be még a szubsztrátum acetamido csoportja a ródiumhoz történő koordinációja miatt. (A kationos ródium komplex oxofil tulajdonságokkal bír, így nem meglepő az alkén-szerves karbonil “hemilabilis” komplex létrejötte.)
![\includegraphics[width=0.95\textwidth]{hidrogen/knowles_quadrants}](img249.png)
|
A királis indukciót a már a hidroformilezéses fejezetben bemutatott kvandráns modell segítségével lehet értelmezni (13.7 ábra). Az énamid úgy koordinálódik a fémhez, hogy a másodlagos donor atom (oxigén) az egyik kvandránshoz, a szubsztituált alkén a másik kvadránshoz tartozik, és az elrendeződések közül az lesz a dihidrogén számára a reakcióképesebb, ahol az aromás csoportok sztérikus gátlása a legkisebb.
A Rh-katalizált aszimmetrikus C=C hidrogénezésről rendkívüli mennyiségű eredmény létezik a szakirodalomban. Itt most csak még egy példát ragadunk ki, ahol konjugált dién átalakítása során értek el kiváló optikai hozamot.Burk et al. [1998]
A szerzők az [((R,R)-Et-DuPhos)Rh(COD)]OTf komplexet állították elő és konjugált 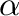 ,
,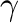 -diénamid-észterek hidrogénezésére alkalmazták. A katalizátor szelektíven csak az énamid egységhez tartozó C=C kettöskötést hidrogénezte, a távolabbi kettőskötés érintetlen maradt. (A teljesen telített termékek aránya 0,5% alatt volt.) Ez feltehetően annak köszönhető, hogy az énamid molekularészen belül a karbonil oxigén a ródiumhoz történő koordinációjával folyamatosan ott tudja tartani a C=C kötést a ródiumhoz közel, de a kölcsönhatás még a telítődést követően sem szűnik meg.
-diénamid-észterek hidrogénezésére alkalmazták. A katalizátor szelektíven csak az énamid egységhez tartozó C=C kettöskötést hidrogénezte, a távolabbi kettőskötés érintetlen maradt. (A teljesen telített termékek aránya 0,5% alatt volt.) Ez feltehetően annak köszönhető, hogy az énamid molekularészen belül a karbonil oxigén a ródiumhoz történő koordinációjával folyamatosan ott tudja tartani a C=C kötést a ródiumhoz közel, de a kölcsönhatás még a telítődést követően sem szűnik meg.
A rendszer regio- és enantioszelektivitása egyaránt kiugróan nagy volt (95%, illetve 99%) jó átalakítási frekvencia mellett. A DuPhos ligandum (S,S) enantiomerjét alkalmazva a 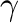 ,
,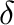 -telítetlen aminosav másik enantiomerjét is ugyanolyan kedvező paraméterekkel sikerült előállítani.
-telítetlen aminosav másik enantiomerjét is ugyanolyan kedvező paraméterekkel sikerült előállítani.