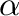 -fenil-sztirol melléktermék is.
-fenil-sztirol melléktermék is.
A Mizoroki-Heck-reakció (gyakran csak Heck reakció) valamilyen telítetlen (általában aromás) halogenid (vagy triflát) reakciója alkénnel, bázis és átmenetifém katalizátor jelenlétében.
Formálisan pl. az alkén hidrogénjét egy aril csoportra cseréljük. Richard F. Heck 2010-ben megosztva Nobel-díjat kapott ezért, míg szegény Tsutomu MizorokinakMizoroki et al. [1971] még Wikipédia oldala sincsen (e sorok írásakor). Meg kell persze jegyezni, hogy az alapok lerakása és a részletek kidolgozása is főleg Heck érdeme. Schoenberg and Heck [1974], Heck and Nolley Jr [1972], Schoenberg et al. [1974], Schoenberg and Heck [1974]
Az általa elsőként, 1972-ben publikált munka még foszfin és oldószer nélkül célozta meg a sztilbén előállítását, később közölte a 7.3. ábra felső részén látható reakciót. A sztilbén főtermék mellett néha megjelenik az 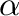 -fenil-sztirol melléktermék is.
-fenil-sztirol melléktermék is.
![\includegraphics[width=100mm]{keresztkapcs/heckek}](img155.png)
|
Ha nem is gyakran, de találhatunk a Heck-reakcióra olyan példákat is, amik palládium helyett más átmenetifémekre (Ni, Pt, Co, Rh, Ir, Ru) alapulnak. Egy ilyen példa látható a 7.3. ábra alján is, ahol a Ni(0)-foszfit katalizátort szervetlen bázissal és N-metil-2-pirrolidon oldószerrel kombinálják. Megjegyzendő, hogy ez a rendszer magasabb hőmérsékletet igényel egy hasonló palládiumos rendszerhez képest.
Potenciális ipari alkalmazásként a rezveratrol előállítását lehet megemlíteni (7.4. ábra). A reakció érdekessége, hogy oxim ligandumot tartalmazó dimer Pd-komplex a prekurzor.
A Heck-reakció mechanizmusa annyira sokféle lehet a katalizátorok, szubsztrátumok, oldószerek, ligandumok és egyéb tényezők függvényében, hogy önmagában erről száz oldalon lehetne írni, és szoktak is. Mi ezt most meg se kíséreljük mind bemutatni, hanem megelégszünk egy gyakori és viszonylag általános mechanizmussal, ami a spekuláción kívül számításos alapon is nyugszik (7.5. ábra). A Pd(0) komplex oxidatív addíciós reakcióba lép az aril halogeniddel (1), majd a Pd(II) komplex ligandumvesztéssel egy egyensúlyi lépésben felszabadít egy koordinációs helyet (2) az érkező alkén számára, mely  -(C,C) kölcsönhatást létesít a palládiummal (3).
-(C,C) kölcsönhatást létesít a palládiummal (3).
Az alkén syn-inzercióval beékelődik a Pd-aromás szén kötésbe (4), majd a két 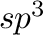 szénatom gyors rotációjával (5) kialakul egy olyan alkil komplex, mely
szénatom gyors rotációjával (5) kialakul egy olyan alkil komplex, mely 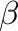 -hidrid eliminációra (6) alkalmas pozícióban hagy egy metilén hidrogént. Az elimináció után egy Pd-H komplexünk van, mely
-hidrid eliminációra (6) alkalmas pozícióban hagy egy metilén hidrogént. Az elimináció után egy Pd-H komplexünk van, mely  -(C,C) kölcsönatással koordinálja a sztilbén (vagy az azzal analóg belső olefin) terméket. A termék alkén kiválása után (7) már csak a HX hidrogén halogenid reduktív eliminációja van vissza, mely alapvetően bázis nélkül is végbe tudna menni, azonban a HX eltávolításához már feltétlenül szükséges a bázis, jelen esetben a trialkil amin, mely trialkil-ammónium sóvá alakul (8). A reduktív elimináció szintén Pd(0) komplexet eredményez, mely alkalmas az újabb kör elkezdésére.
-(C,C) kölcsönatással koordinálja a sztilbén (vagy az azzal analóg belső olefin) terméket. A termék alkén kiválása után (7) már csak a HX hidrogén halogenid reduktív eliminációja van vissza, mely alapvetően bázis nélkül is végbe tudna menni, azonban a HX eltávolításához már feltétlenül szükséges a bázis, jelen esetben a trialkil amin, mely trialkil-ammónium sóvá alakul (8). A reduktív elimináció szintén Pd(0) komplexet eredményez, mely alkalmas az újabb kör elkezdésére.
Megemlítendő, hogy a koordinálódó olefin szubsztituensének térállása nem csak egyféle lehet, így az inzercióval létre jöhet az 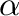 -fenil-sztirol is, ahol az aril szén nem a terminális, hanem a belső szénatommal kapcsolódik össze. Általában a C-C kötés kialakulása a sebességmeghatározó lépés, pontosabban az alkén koordinációja és az azt követő beékelődés, az alkén koordinációja/disszociációja/belső rotációja ennél gyorsabb. Ebből következik, hogy ez a lépés a Curtin-Hammett kinetikát követi és így a regioszelektivitás a két aktiválási szabadentalpia különbségéből számolható/megbecsülhető. A reakciósebesség növelhető, ha az aril-csoporton növeljük az elektronsűrűséget, vagy ha az alkénen csökkentjük. Elektronhiányos alkéneknél (pl. metil-metakrilát) fordulhat a trend, ilyenkor az aril csoporton csökkentve az elektronsűrűséget is növekedhet a reakciósebesség.
-fenil-sztirol is, ahol az aril szén nem a terminális, hanem a belső szénatommal kapcsolódik össze. Általában a C-C kötés kialakulása a sebességmeghatározó lépés, pontosabban az alkén koordinációja és az azt követő beékelődés, az alkén koordinációja/disszociációja/belső rotációja ennél gyorsabb. Ebből következik, hogy ez a lépés a Curtin-Hammett kinetikát követi és így a regioszelektivitás a két aktiválási szabadentalpia különbségéből számolható/megbecsülhető. A reakciósebesség növelhető, ha az aril-csoporton növeljük az elektronsűrűséget, vagy ha az alkénen csökkentjük. Elektronhiányos alkéneknél (pl. metil-metakrilát) fordulhat a trend, ilyenkor az aril csoporton csökkentve az elektronsűrűséget is növekedhet a reakciósebesség.