![\includegraphics[width=100mm]{keresztkapcs/carbcouplings}](img180.png)
|
A kapcsolási reakciók külön kategóriáját képviselik mindazok, melyek szénmonoxid beépüléssel járnak. Az 7.26. ábra néhány olyan figyelemreméltó példát vonultat fel, melyek kellően szelektívek, emellett szintetikus szempontból jelentősek.
![\includegraphics[width=100mm]{keresztkapcs/carbcouplings}](img180.png)
|
A karbonilatív Suzuki reakció diaromás ketonok előállítására alkalmas, változatos szerkezetű aril-halogenidekből (vagy triflátokból) és boronsavakból kiindulva (a).Ishiyama et al. [1998] Beller és munkatársai jódaromás vegyületekből és sztirol származékokból aromás enonokat szintetizáltak (b).Wu et al. [2010]
Mori és munkatársai
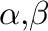 -alkinil ketonokat állítottak elő fenilacetilén és jódaromások reakciójában réz(I)-jodid, szénmonoxid és ammónia jelenlétében (c).Mohamed Ahmed and Mori [2003]
Szintén a Beller-féle kutatócsoport nevéhez fűződik a karbonilatív Negishi-reakció egy szelektív alkalmazása, melynek segítségével 1,2-diaril-etanonokat preparáltak helyettesített jódaromásokból és benzil-kloridokból kiindulva (d).
Wu et al. [2012]
-alkinil ketonokat állítottak elő fenilacetilén és jódaromások reakciójában réz(I)-jodid, szénmonoxid és ammónia jelenlétében (c).Mohamed Ahmed and Mori [2003]
Szintén a Beller-féle kutatócsoport nevéhez fűződik a karbonilatív Negishi-reakció egy szelektív alkalmazása, melynek segítségével 1,2-diaril-etanonokat preparáltak helyettesített jódaromásokból és benzil-kloridokból kiindulva (d).
Wu et al. [2012]
A fenti példákon túl, ahol szén-karbonil szén-szén kapcsolás történik, említésre érdemesek azon reakciók, ahol szén-karbonil szén-heteroatom kötések kerülnek kialakításra. Erre a kategóriára egy jellemző példa az alkoxikarbonilezés (vagy inkább ariloxikarbonilezés), mely alkoholokból kiindulva észterek szintézisére nyújt lehetőséget. A 7.26 ábrán (e) egy olyan példát láthatunk, melynél katalizátorként magnetit hordozóra felvitt palládium nanorészecskék szolgáltak katalizátorként. A magnetit nanorészecskék a hordozóhoz rögzített (heterogenizált, más néven immobilizált) katalizátorok területén rendkívül ígéretes katalizátorrendszerek, mivel a mágnesezhetőségük és nagy fajlagos felületük lehetővé teszi a katalizátorok újrahasznosítását és a reakcióelegytől történő majdnem teljes elválasztását. Prasad and Satyanarayana [2013]
A fenti (különösen az a-d) esetekben gyakori mellékreakció az ún. homokapcsolt termék, amikor a karbonilezéses változat helyett az alapreakció, azaz pl. a “hagyományos” Suzuki-reakció játszódik le.
Az aminokarbonilezési reakciót tulajdonképpen lehetne karbonilatív Buchwald-Hartwig-reakciónak hívni, azonban ezzel így leírva sosem találkoztam. Ennek oka lehet az is, hogy az aminokarbonilezés (még ha régebben nem is így hívták) előbb került a kutatások célkeresztjébe mint a nem karbonilatív reakció. Az aminokarbonilezés reakcióegyenletére egy konkrét példa látható a 7.27. ábrán.
Itt a 4-szubsztituált jódbenzolokat primer aminokkal reagáltattuk, de gyakori a szekunder aminok (pl. morfolin) alkalmazása is. Látható, hogy az amidon kívül számolni kell a kettős karbonilezéssel keletkező ketoamiddal is; hogy ezek milyen arányban keletkeznek, ez függ a CO nyomástól (nagyobb nyomás a két CO beépülésének kedvez), a katalizátortól, az oldószertől és az amintól is. Ha a szubsztrátum jódalkén, akkor egy-két kivételtől eltekintve nem jellemző a ketoamid keletkezése. Oldószerként általában DMF-et, ritkábban toluolt szoktak alkalmazni, de működik a rendszer exotikusabb megújuló oldószerekben (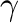 -valerolakton, eukaliptol) is.
-valerolakton, eukaliptol) is.
A reakció mechanizmusával kapcsolatban általában csak feltételezésekbe szoktak bocsátkozni, a teljes mechanizmus felderítésén jelenleg is dolgozunk. (Igazság szerint részben erre egy PhD munka is épült és jelenleg rengeteg módját fel tudjuk írni annak, hogy hogyan nem megy a reakció, legalábbis az amido-karbonil komplexhez vezető részlépés.)
A reakció itt is a jódalkén (vagy alkenil-jodid) palládiumra történő oxidatív addíciójával indul (1). Említésre méltó, hogy itt az elméleti számítások nagyon erősen arra engednek következtetni, hogy a 14 elektronos Pd0(PPh3)(CO) komplex az aktív katalizátor. A Pd0(PPh3)2 majdnem ugyanannyira aktív, azonban a keletkező Pd(II) komplexben egy trifenilfoszfin mindenképpen kicserélődik CO-ra. A szén-monoxid beékelődése intramolekuláris (2), tehát a gyakorta látható ábrázolással ellentétben nem a külső gáztérből érkezik. (Ez amúgy termodinamikai szempontból is belátható, ugyanis ha gyors a részlépés (márpedig itt a CO-inzerció kifejezetten gyors), akkor feltétlenül előnyt élvez egy entrópia szempontjából neutrális lépés az entrópiacsökkenéssel szemben.) A koordinatíve telítetlen benzoil komplex aztán koordinál a CO atmoszférából egy karbonil ligandumot (3). Ami aránylag fehér folt a mechanizmusban, az a (4) szakasz. Itt a bázis az aminról elvisz egy hidrogént, a palládiumról a jódot és kapunk egy amido karbonil komplexet, ahol az amid és benzoil funkciós csoportok reduktív elimináció formájában távoznak a palládiumról amid termék formájában.
A kettős karbonilezés mechanizmusa körül is akad némi bizonytalanság. Egyesek ionos intermediert feltételeznek, szerintünk inkább az ábrán bordóval jelölt Pd(PPh3)(benzoil)(CO)(NR2) komplexben ékelődik be a CO a Pd-N kötésbe, ez a folyamat ugyanis viszonylag gyors (6). Az így létrejövő karbamoil csoport aztán a benzoillal összekapcsolódva távozik ketoamidként a palládium(II)-ről visszaadván a kiindulási Pd(0) komplexet (7). Érdemes még megjegyezni, hogy elvi lehetőségként szóba jöhet a szó szerint értendő kettős karbonilezés is, tehát amikor a karbonil ligandum nem a fém-nitrogén, hanem a fém-acil kötésbe ékelődik be. Ennek a lépésnek az akativálási szabadentalpiagátja azonban több mint kétszerese a (6) számú lépésének, így ez csak elvi lehetőségként merül fel.